Unterschied osmose diffusion verständlich erklärt
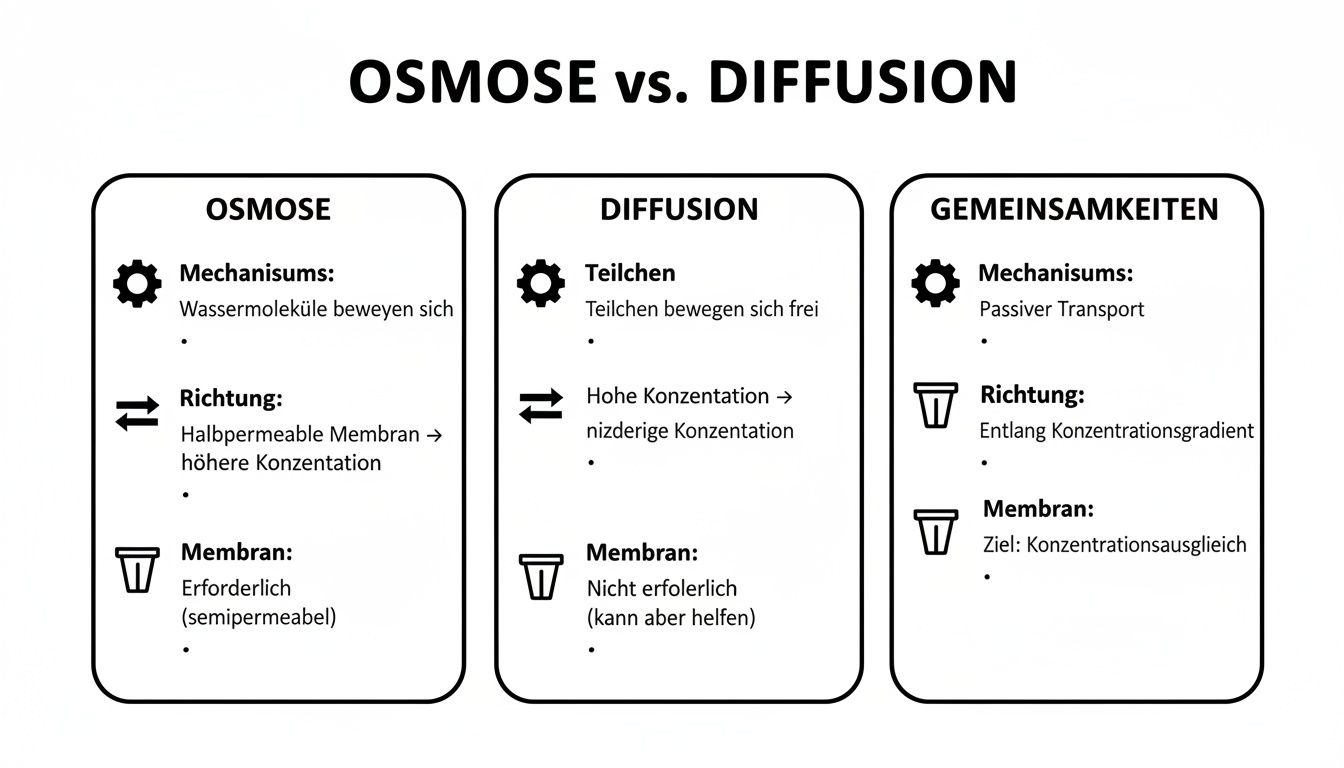
Im Kern laufen Osmose und Diffusion auf unterschiedliche Richtungen und Voraussetzungen hinaus. Dabei steht Osmose für den gerichteten Wassertransport durch eine semipermeable Membran, während Diffusion den zufälligen Ausgleich von Teilchenkonzentrationen beschreibt.
Unterschiede osmose diffusion verstehen
Wer Osmose und Diffusion im Labor oder in Klausuren präzise erklären will, sollte ihre treibenden Kräfte und Rahmenbedingungen klar differenzieren.
Bei der Osmose zwingt der osmotische Druck Wasser durch eine Membran. Diffusion hingegen folgt dem Konzentrationsgradienten, ohne dass eine Barriere nötig ist.
-
Mechanismus
• Osmose: gerichteter Wasserfluss durch semipermeable Membran
• Diffusion: passiver Teilchentransport entlang des Gradienten -
Treibende Kraft
• Osmose: osmotischer Druck
• Diffusion: Konzentrationsdifferenz -
Membran
• Osmose: Membran erforderlich
• Diffusion: kann membranfrei ablaufen
Diese Unterscheidungen sind essenziell, um Experimente wie Zellkultur-Quellung oder Gasaustausch umfassend zu verstehen.
Osmose findet man zum Beispiel in zellbiologischen Versuchen, wenn Zellen ihr Volumen ändern. Diffusion beobachtet man im Biologielabor oft bei der Farbausbreitung im Wasser.
Vergleich osmose diffusion
Im folgenden Vergleich siehst du, wie Mechanismus, Bewegungsrichtung und Voraussetzungen beider Prozesse zueinanderstehen:
| Kriterium | Osmose | Diffusion |
|---|---|---|
| Mechanismus | Gerichteter Wasserfluss durch semipermeable Membran | Passiver Teilchentransport entlang des Gradienten |
| Bewegungsrichtung | Von niedriger zu höherer gelöster Stoffkonzentration | Von hoher zu niedriger Teilchenkonzentration |
| Voraussetzungen | Semipermeable Membran, osmotischer Druck | Konzentrationsgefälle, keine Membran nötig |
Aus dieser Gegenüberstellung wird klar, dass Osmose immer eine Selektivbarriere und gerichtete Wasserbewegung erfordert, während Diffusion universell entlang des Gradienten abläuft.
Osmose ist eine spezielle Form der Diffusion, bei der ausschließlich das Lösungsmittel Wasser durch spezifische Membranen transportiert wird.
Situative empfehlung
- Zellkulturversuche: Osmose über Volumen- oder Gewichtsunterschiede bestimmen
- Farbstoffausbreitung im Wasser: Diffusion ohne Membran demonstrieren
- Prüfungen zur Membranfunktion: Osmose klar als gerichteten Prozess benennen
- Klinische Modelle: Diffusion zur Simulation der Wirkstoffverteilung im Gewebe nutzen
Mit diesem Wissen packst du Prüfungsfragen sicher an und setzt Laborversuche korrekt um. Merke dir: Osmose heißt immer Wassertransport über eine Barriere, Diffusion den universellen Teilchenausgleich.
Physikalische Grundlagen Osmose und Diffusion
In diesem Abschnitt steigen wir in die physikalischen Prinzipien von Osmose und Diffusion ein und legen damit das Fundament für alle weiteren Vergleiche.
Der Konzentrationsgradient ist dabei die zentrale Triebkraft, die Teilchen und Lösungsmittel in passive Transportprozesse einbindet.
Konzentrationsgradient und treibende Kraft
Ein Konzentrationsgefälle entsteht stets, wenn Moleküle in zwei Zonen ungleich verteilt sind.
Spontan wandern Teilchen aus Bereichen hoher in solche niedriger Konzentration, um das freie chemische Potenzial zu minimieren.
Dieses Verhalten folgt dem zweiten Hauptsatz der Thermodynamik und sorgt für Ausgleichsvorgänge ohne Energieaufwand.
- Osmose: Wasser bewegt sich durch eine semipermeable Membran, bis das chemische Potenzial balanciert ist.
- Diffusion: Gelöste Stoffe verteilen sich entlang des Konzentrationsgradienten im Medium.
Semipermeable Membran und Selektivität
Semipermeable Membranen agieren wie Filter: Sie lassen bestimmte Moleküle passieren und halten andere zurück.
In biologischen Systemen regulieren Proteinkanäle, welche Ionen oder Wasser in die Zelle gelangen dürfen.
„Osmose ist an das chemische Potenzial gebunden, während Diffusion den reinen Konzentrationsausgleich beschreibt.“
Dieser Unterschied hebt hervor, dass Osmose eine spezielle Form der Diffusion ist, bei der ein Lösungsmittel bevorzugt transportiert wird.

Die Abbildung verdeutlicht, wie Teilchen eine Membran überwinden, bis sich beide Seiten im Gleichgewicht befinden.
Diffusionskoeffizienten in verschiedenen Medien
Nachfolgend findest du typische Werte für den Diffusionskoeffizienten bei 25 °C. Diese Kennzahlen unterstützen die Planung und Interpretation von Experimenten.
| Medium | Diffusionskoeffizient (m²/s) |
|---|---|
| Reines Wasser | 2,299·10⁻⁹ |
| Zellkultur | 0,5·10⁻⁹ – 2·10⁻⁹ |
| Lebensmittel | 1·10⁻⁹ |
In reinem Wasser liegt der Selbstdiffusionskoeffizient bei etwa 2,299·10⁻⁹ m²/s.
Biologische Proben zeigen für kleine Moleküle Werte zwischen 0,5·10⁻⁹ und 2·10⁻⁹ m²/s.
Diese Referenzdaten liefern in vielen deutschen Laboren eine zuverlässige Grundlage für Transportanalysen.
Zusammenhang Osmose und Diffusion in Zellen
In der Zellbiologie wirken Osmose und Diffusion oft Hand in Hand. Wasser, das durch Osmose strömt, verändert lokale Konzentrationsgefälle und beeinflusst so die Diffusionsgeschwindigkeit.
So reguliert die Zelle ihr Volumen und hält den inneren Druck konstant.
Mehr zur Membranlogistik findest du in unserem Artikel über Endozytose und Exozytose.
Praktische Empfehlungen für Laborexperimente
Damit Osmose- und Diffusionstests reproduzierbar gelingen, haben sich folgende Punkte bewährt:
- Temperatur konstant bei 25 °C halten
- Messgeräte vor jedem Versuch sorgfältig kalibrieren
- Konzentrationsgradienten exakt dokumentieren
Mit diesen Routinen erzeugst du verlässliche Daten in Zellkultur- und Gewebeproben.
Ausblick chemisches Potenzial in Medizin
Ein präzises Verständnis des chemischen Potenzials ist essenziell, um Wasserflüsse im Gewebe vorherzusagen.
Pharmakokinetische Modelle nutzen Diffusionsraten, um den Wirkstofftransport im Blut zu simulieren.
Beide Phänomene sind damit unverzichtbar für die Entwicklung therapeutischer und diagnostischer Verfahren.
Vertiefung chemisches Potenzial
Das chemische Potenzial Φ integriert Konzentration, Druck und Temperatur in einer einzigen Formel für die freie Energieänderung. In idealen Lösungen verläuft sein Gradient parallel zum Konzentrationsgradienten.
- Osmotischer Druck π = c·R·T (van’t Hoff)
- Ficksches Gesetz J = –D·dC/dx
Hierbei beschreibt J die Teilchenflussdichte, D den Diffusionskoeffizienten und dC/dx den lokalen Gradient. Kalibrierstandards helfen, D in diversen Medien experimentell zu bestimmen.
Anwendungsbeispiele Niere und Blut
In den Nierentubuli steuert Osmose die Rückresorption von Wasser. Gleichzeitig garantiert Diffusion den selektiven Austausch von Ionen zwischen Blut und Gewebe.
Dieses Zusammenspiel sichert Homöostase und reguliert das Flüssigkeitsgleichgewicht im gesamten Organismus.
Didaktische Tipps für Medizinstudierende
Experimentiere im Seminar mit Lebensmittelfarbe und Dialysebeuteln, um Osmose plastisch zu demonstrieren.
Karteikarten zu Fickschem und van’t-Hoff’schem Gesetz erleichtern das Lernen.
Verknüpfe stets Laborprotokolle mit den mathematischen Modellen, um Theorie und Praxis zu verschränken.
Schlussfolgerung Grundlagen
Osmose und Diffusion zeigen eindrucksvoll, wie Stoffe ohne Energieaufwand wandern.
Mit klar definierten Parametern und präzisen Kennwerten lassen sich biomedizinische Fragestellungen zuverlässig angehen.
Glossare und visuelle Hilfsmittel wie Diagramme und Tabellen unterstützen dabei, komplexe Konzepte nachhaltig zu verankern.
Mathematische Modelle Osmose und Diffusion

In diesem Kapitel vergleichen wir die mathematischen Hintergründe von Osmose und Diffusion. Zum einen leiten wir das Ficksche Gesetz her, zum anderen erklären wir, wie das van’t Hoff Gesetz den osmotischen Druck beschreibt. Abschließend zeigen zwei anschauliche Beispielrechnungen, wie diese Formeln im Labor und im Körper Anwendung finden.
Ficksches Gesetz ableiten
Der Basisgedanke: Teilchen wandern von Bereichen hoher Konzentration in Niedrigkonzentration. Mathematisch fasst das Fick’sche Gesetz diesen Prozess in der Formel J = –D·dC/dx zusammen.
- D (Diffusionskoeffizient) in m²/s steht für die Beweglichkeit der Moleküle.
- dC/dx (Konzentrationsgradient) in mol/m⁴ zeigt, wie stark der Unterschied ist.
- J (Flussdichte) in mol/(m²·s) gibt an, wie viele Teilchen pro Fläche und Zeit passieren.
| Parameter | Symbol | Einheit |
|---|---|---|
| Diffusionskoeffizient | D | m²/s |
| Konzentrationsgradient | dC/dx | mol/m⁴ |
| Flussdichte | J | mol/(m²·s) |
Kernaussage: Der Fluss wächst proportional zum Diffusionskoeffizienten und zum Konzentrationsgradienten.
van’t Hoff Gesetz erklären
Osmotischer Druck entsteht, wenn gelöste Teilchen an einer semipermeablen Membran anstoßen und Druck aufbauen. Die Formel lautet:
π = i·c·R·T
- i (Van’t-Hoff-Faktor): Anzahl der gelösten Teilchen pro Formeleinheit.
- c (Konzentration) in mol/L.
- R = 0,08206 L·atm/(mol·K) (Gaskonstante).
- T in Kelvin.
π beschreibt den Druck, der benötigt wird, um die Nettobewegung von Wasser zu stoppen.
Beispielrechnungen
-
Glukosediffusion im Cytoplasma
Mit D = 6·10⁻¹⁰ m²/s und einem Gradient von 1 mol/m³ pro 1 µm erhält man
J ≈ –6·10⁻⁴ mol/(m²·s). -
Osmotischer Druck in Blutprobe
Für c = 0,15 mol/L, i = 2, R = 0,08206 L·atm/(mol·K) und T = 310 K ergibt sich
π ≈ 7,6 atm (≈ 7730 kPa).
Tipps zur Rechnung:
- Werte exakt einsetzen
- Einheiten sorgfältig konvertieren
- Ergebnis in gewünschte Einheit umrechnen
Hinweis: Einheitensicherheit verhindert Rechenfehler.
Praktische Anwendung
Studierende der Medizin nutzen diese Modelle für:
- Laborversuche zur Glukoseverteilung
- Analyse von Filtrationsdruck in der Dialyse
- Simulation des Gefäßdrucks im Kreislaufsystem
| Anwendung | Formel | Zielgröße |
|---|---|---|
| Diffusionsmessung | J = –D·dC/dx | Flussdichte J |
| Osmotische Druckbestimmung | π = i·c·R·T | Druck π (atm) |
Mit diesen Grundlagen lassen sich Zellvolumenänderungen oder Wasserbewegungen in Geweben präzise modellieren.
Tool-Anwendung
Interaktive Werkzeuge unterstützen bei Parameterstudien:
- Jupyter Notebooks für Live-Berechnungen in Python
- Excel zur schnellen Visualisierung von D und dC/dx
- R Shiny Apps für interaktive π-Diagramme
Experimentiere mit Grenzwerten, um Annahmen zu prüfen.
Zusätzliche Hinweise
- Berücksichtige die Temperaturabhängigkeit von D und R.
- Teste verschiedene i-Werte, besonders bei Elektrolyten.
- Dokumentiere alle Umrechnungen systematisch.
Variiere den Konzentrationsgradienten und notiere die J-Werte, um D zu kalibrieren und mit Literaturdaten abzugleichen.
Erweiterte Modelle
Komplexere Ansätze verbinden Flussgleichungen mit Membrandynamik:
- Kedem-Katchalsky-Gleichungen für gekoppelte Wasser- und Solutflüsse
- Aktivitätskoeffizienten bei nicht idealen Lösungen
- Multikomponentenmodelle für realistische biologische Systeme
In klinischen Studien helfen solche Modelle, Ödembildung und Flüssigkeitsverschiebungen genauer einzuschätzen.
Komplexere Modelle führen zu präziseren Vorhersagen in der Biomedizin.
Beispielerweiterte Anwendung
Bei Dialyse lassen sich so optimieren:
- Simulation der Ultrafiltration in Dialysegeräten
- Prognose von Elektrolytverschiebungen
- Planung der Osmotherapie bei Hirnödem
Diese Szenarien zeigen, wie theoretische Gleichungen direkt in den klinischen Alltag fließen.
Fazit rechnerische Modellierung
Die Kombination aus Fickschem und van’t Hoff Gesetz liefert eine belastbare Basis für experimentalwissenschaftliche und theoretische Arbeiten in Biomedizin und Medizintechnik.
- Kernpunkte:
• Ficksches Gesetz quantifiziert den Teilchenfluss
• van’t Hoff Gesetz beschreibt den osmotischen Druck
• Simulationstools vereinfachen Parameterstudien
• Erweiterte Modelle erhöhen die klinische Aussagekraft
Regelmäßiges Üben von Beispielrechnungen stärkt den sicheren Umgang mit Einheiten und Formeln. Viel Erfolg dabei!
Anwendungen Osmose und Diffusion vergleichen
In diesem Abschnitt werfen wir einen Blick auf konkrete Beispiele aus Biologie und Technik, in denen beide Phänomene zentrale Rollen spielen. Wir untersuchen Effizienzparameter, Energiebedarf und typische Einsatzfelder.

Die Grafik fasst Vergleichsdaten zu Umkehrosmose und Diffusion in Industrieanlagen zusammen. Sie stellt Effizienzkennzahlen und Energieverbräuche gegenüber.
Biologische Anwendungen vergleichen
Schon in der Atmung sind beide Prozesse unverzichtbar.
Diffusion transportiert Sauerstoff aus den Alveolen ins Blut, Osmose steuert den Wasserhaushalt zwischen Plasma und Gewebe.
Insight
Wasser wandert per Osmose durch die Nierentubuli, während Ionen und Nährstoffe via Diffusion rückresorbiert werden.
In den Nierenkanälchen sichern Osmose und Diffusion zusammen die homöostatische Balance.
- Zellatmung
• O₂-Diffusion in Erythrozyten
• CO₂-Austritt ins Alveolarlumen - Nierenfunktion
• Wasser-Rückgewinnung via Osmose
• Ionen-Transport entlang von Gradienten
Mehr zur Aufbau und Funktion der Niere findest du in unserem Guide.
Im Labor verdeutlichen Experimente den Unterschied:
- Versuchsdauer 30–60 Minuten
- Photometrische Messung des Konzentrationsgefälles
- Dokumentation über Zeitreihenbilder
Und in der Lunge sorgt eine Membrandicke von < 1 µm für einen schnellen Gasaustausch:
- Partialdruckdifferenz O₂: 100 mmHg vs. 40 mmHg
- Austauschrate 200–300 ml/min
Technische Anwendungen vergleichen
Umkehrosmoseanlagen filtern Trinkwasser mit 95–99 % Salzrückhalt. Der Energiebedarf liegt bei 2–6 kWh/m³ aufbereitetem Wasser in großindustriellen Anlagen.
Erfahre mehr über industrielle Osmoseverfahren auf Bluewater Shop.
Dialysegeräte kombinieren Osmose und Diffusion:
Im Diffusionsmodul gelangen Abfallstoffe aus dem Blut ins Dialysat; im ultrafiltrativen Bereich entzieht Osmose überschüssige Flüssigkeit.
| Anwendung | Osmose | Diffusion |
|---|---|---|
| Umkehrosmose | Wassertransport, 95–99 % Salzrückhalt | n.a. |
| Dialyse | Ultrafiltration (Flüssigkeitsentfernung) | Ionen- und Molekültransport |
| Gasaustausch | n.a. | O₂/CO₂-Transport in Lunge und Gewebe |
Bei Meerwasserentsalzung sind Drücke bis 70 bar nötig:
- Standarddruck Süßwasser: < 10 bar
- Hochdruckanlagen: bis 80 bar
- Membranmaterial entscheidend für Stabilität
In der chemischen Industrie trennt man Gasgemische (z. B. CO₂/CH₄) per Diffusion:
- Diffusionskoeffizient CO₂-CH₄: ~ 1·10⁻⁷ m²/s
- Geringerer Energieverbrauch als Kompressionsverfahren
- Typische Anwendung in Biogas-Aufbereitung
Tipp In Industrieprozessen wird Osmose oft zur Salzentfernung und Diffusion zur Gastrennung eingesetzt.
Situative Empfehlungen geben
Für Praktika im Labor bieten sich folgende Versuche an:
- Labor lernen
a) Diffusion im Agar mit Farbstoff
b) Osmose mit Kartoffelstreifen und Kochsalzlösung - Klinikstudien
a) Simulation der Nierenfiltration
b) Auswertung von Dialyseprotokollen - Industrieplanung
a) Dimensionierung von Umkehrosmosemodulen
b) Energiebedarfskalkulation basierend auf Effizienzdaten
Diese Übungen unterstützen nicht nur Verständnis, sondern auch die Prüfungsvorbereitung und Projektplanung.
Unterricht und Forschung
In der Lehre veranschaulichen Fallbeispiele aus Lunge und Niere die Mechanismen. Forschungsteams nutzen:
- FCS (Fluoreszenzkorrelationsspektroskopie)
- FRAP (Fluoreszenz-Photobleaching-Analyse)
- Quantitative Bewertung von Membrandurchlässigkeit
Osmose liefert Daten zu Druckänderungen, Diffusion quantifiziert Molekülbewegungen – gemeinsam entstehen umfassende Datensätze für neue Membransysteme.
Kernaussage
Entscheide nach gewünschter Selektivität und Energieeffizienz.
Entscheidungshilfe Anwendungen
Die Wahl zwischen Osmose und Diffusion hängt ab von:
- Membranverfügbarkeit
- Erforderlichem Selektivgrad
- Energieeffizienz
Für präzise Wasseraufbereitung empfiehlt sich Osmose, bei schneller Gas- oder Molekültrennung Diffusion.
- Empfehlung: Dokumentiere stets Medium, Konzentration und Temperatur
Damit endet unser praxisnaher Vergleich. Viel Erfolg bei der Anwendung!
Typische Fehlvorstellungen Osmose Diffusion
Im Biologieunterricht schleichen sich immer wieder dieselben Irrtümer ein, wenn Studierende über Osmose und Diffusion sprechen.
Häufig führen diese Missverständnisse dazu, dass grundlegende Konzepte nicht richtig verankert werden.
Nachfolgend ein kurzer Überblick bewährter Fehlannahmen:
-
Irrtum: Osmose als aktiver Prozess
Tatsächlich ist Osmose ein passiver Vorgang, der entlang des osmotischen Drucks abläuft, ganz ohne Energieverbrauch der Zelle. -
Irrtum: Diffusion nur bei Gasmolekülen
Erleichterte Diffusion transportiert auch größere Moleküle über spezielle Kanalproteine. -
Irrtum: Membran nicht selektiv
Semipermeable Membranen nutzen Transportproteine, um Stoffe gezielt auszuwählen.
Diese Gegenüberstellung zeigt, wie leicht man beim Stofftransport falsche Schlüsse ziehen kann.
Ursachen für verbreitete Fehlannahmen
Oft bleiben Lehrbücher in der Theorie stecken und verzichten auf greifbare Beispiele.
Laborversuche fehlen im Schulalltag, sodass man die Prozesse nie selbst beobachtet.
Studien zur naturwissenschaftlichen Grundbildung in Deutschland belegen, dass nach Sekundarstufe I 25–40 % der Schülerinnen und Schüler noch konzeptuelle Lücken bei Osmose (etwa aktive Stoffwanderung) oder Diffusion haben. Erfahre mehr zu Missverständnissen zu Osmose und Diffusion auf lernigo.de
Ein Screenshot fasst zentrale Statistiken zu Fehlannahmen grafisch zusammen.
Die Grafik veranschaulicht Fehlerraten je nach Schultyp und Region und verdeutlicht den Einfluss praxisnaher Demonstrationen.
Viele Irrtümer entstehen, weil aktive und passive Transportmechanismen nicht klar differenziert werden.
Praktische Wege zur Korrektur
Kartoffelstreifen-Versuch
Visualisiert den passiven Wassertransport durch folgende Schritte:
- Kartoffelstreifen vor und nach Kochsalzbad wiegen
- Volumenänderung als Maß für den osmotischen Fluss interpretieren
Dialysemembranen-Experiment
Zeigt die Selektivität semipermeabler Membranen:
- Verschiedene Membranporen einsetzen
- Molekülgröße gegen Permeabilität abgleichen
Färbungslösungen in Zellkultur
Macht Diffusionsgeschwindigkeiten sichtbar:
- Zeitpunkte dokumentieren
- Konzentrationsverlauf grafisch aufbereiten
Zusätzlich helfen strukturierte Materialien:
- Karteikarten zu Definitionen und Mechanismen festigen Wissen.
- Arbeitsblätter gleichen treibende Kräfte und Gradienten systematisch ab.
- Reflexionsfragen am Ende jeder Einheit fördern die Selbstkontrolle.
Lehrende erhalten dadurch gezieltes Feedback, Studierende schärfen ihr Verständnis durch aktive Teilnahme.
Konkrete Tipps für Selbststudium
- Mindmap erstellen: Verknüpfe Konzepte wie osmotischer Druck und Konzentrationsgradient.
- Flashcards nutzen: Formeln wie π = i·c·R·T und J = –D·dC/dx regelmäßig wiederholen.
- Gruppenarbeit organisieren: Diskutiert typische Irrtümer und korrigiert euch gegenseitig.
- Checkliste verwenden: Dokumentiere Material, Messungen und Beobachtungen systematisch.
Simulationstools ermöglichen virtuelle Experimente, wenn Labore nicht verfügbar sind. Animus Medicus bietet darüber hinaus anschauliche Poster und Illustrationen als Lernhilfe an.
Tipp
Ergänze kurze Videos, um komplexe Abläufe multimedial zu verdeutlichen.
Mit praxisnahen Versuchen, regelmäßigen Feedbackschleifen und gezielter Fehleranalyse lassen sich Missverständnisse zwischen Osmose und Diffusion nachhaltig ausräumen. So erreichen Lehrende und Lernende gemeinsam ein tiefes, langanhaltendes Verständnis.
Lernstrategien Medizinstudierende Osmose Diffusion
Absorbieren Sie Osmose und Diffusion nicht im Schneckentempo, sondern kombiniert aus Theorie, Praxis und smarten Learning-Apps. Mit gezielten Übungen prägen Sie sich auch komplexe Zusammenhänge langfristig ein.
- Karteikarten: Testen Sie Formeln wie π = i·c·R·T und J = –D·dC/dx spielerisch.
- Laborsimulationen: Interaktive Modelle verdeutlichen passive und aktive Transportphänomene.
- Gruppenübungen: Diskutieren Sie Prüfungsfragen im Team und vertiefen Sie Ihr Verständnis.
Werfen Sie persönliche Formeleditionen in Ihre Übungsmappe – das erleichtert das schnelle Nachschlagen. Virtuelle Tools machen den Konzentrationsgradienten anschaulich: Ein Klick genügt.
Formeleditionen und digitale Apps
Sammeln Sie alle relevanten Formeln auf einer Seite. Notieren Sie Variablen prägnant, damit Sie im Ernstfall nicht ins Stocken geraten.
Apps wie Osmosis oder Ihre Uni-eigenen Plattformen simulieren Membranfunktionen in Echtzeit.
„Visualisierung steigert das Verständnis komplexer Transportmechanismen um bis zu 40 %.“
Steuern Sie Szenarien, indem Sie c, D und Membranparameter variieren – und beobachten Sie die Effekte.
Beispielaufgaben gezielt üben
- Berechnen Sie den osmotischen Druck π für c = 0,15 mol/L, i = 2 bei 310 K.
- Simulieren Sie Diffusion in einem Gelblock und dokumentieren Sie J in Abhängigkeit von dC/dx.
- Interpretieren Sie Messergebnisse aus dem Laborpraktikum mit Kartoffelstreifen in Kochsalzlösung.
Solche Übungen schärfen Ihren Umgang mit Einheiten und Einsetzverfahren.
Für weitere Strategien lohnt sich ein Blick auf unseren Artikel zur Studienoptimierung.
Mehr dazu unter Besser lernen Tipps für Medizinstudierende
Nachbereitung und Ressourcen
Regelmäßige Reviews sind das A und O – auch digital.
| Ressource | Zweck |
|---|---|
| Biophysik kompakt | Formeln und Theorien vertiefen |
| Animus Medicus Blogartikel | Praxisnahe Beispiele und Grafiken |
| Online-Simulationen | Interaktive Wiederholung |
Spaced-Repetition-Programme festigen Fakten dauerhaft. Danach empfiehlt sich ein kurzer Check im Peer-Kreis, um Lücken aufzuspüren.
Peer Review und Selbstkontrolle
Feedback von Kommiliton:innen entlarvt früh Misskonzepte.
Expertentipp: Halten Sie Unklarheiten sofort in Ihrem Notizbuch fest.
- Kurze Quizrunden klären Restfragen.
- Erklären Sie Formeln laut, um den roten Faden zu finden.
- Führen Sie ein Fehlerprotokoll und überprüfen Sie es regelmäßig.
Am Ende fasst eine digitale Mindmap alle Zusammenhänge übersichtlich zusammen.
Langfristige Verankerung
Metakognitives Journaling fördert Ihr Bewusstsein fürs eigene Lernen.
- Dokumentieren Sie wöchentlich Fortschritte und offene Punkte.
- Nutzen Sie Apps wie Anki oder Quizlet für den Spaced-Repetition-Algorithmus.
Studien zeigen, dass regelmäßige Wiederholungen den Lernerfolg um 65 % steigern.
Simulieren Sie echte Prüfungssituationen mit Zeitlimit und offenen Fragen. Ergänzen Sie visuelle Hilfsmittel wie Poster von Animus Medicus, um Abläufe plastisch zu verstehen.
Empfohlene Literatur
- Alberts et al., Biochemistry – Zelltransportprozesse im Detail
- Lodish et al., Molecular Cell Biology – umfassende Grundlage
- Animus Medicus Poster zu Osmose und Diffusion – visuelle Übersicht
Diese Werke liefern praxisnahe Fallbeispiele aus Medizin und Forschung. Eine Online-Zusammenfassung finden Sie im Animus Medicus Blog zur Anatomie. Ein Mix aus Formeltraining, Simulation und Peer-Review sichert Ihnen den Prüfungserfolg – jeden Tag aufs Neue!
FAQ Unterschied Osmose und Diffusion
In diesem Abschnitt beantworten wir die wichtigsten Fragen zum Unterschied Osmose und Diffusion übersichtlich und praxisnah.
Dabei werfen wir einen Blick auf Zelltransport, osmotischen Druck und bewährte Laborverfahren.
Ist Diffusion in Zellen energieabhängig?
Grundsätzlich läuft die Diffusion passiv entlang des Konzentrationsgefälles ab – es wird kein ATP verbraucht.
Allerdings können Transportproteine den Prozess beschleunigen, ohne selbst Energie einzusetzen.
- Passiver Transport folgt automatisch dem Konzentrationsgradienten
- Erfordert keine ATP-Bindung oder andere aktive Antriebe
„Erleichterte Diffusion nutzt spezialisierte Proteine, bleibt aber immer energieautonom.“
Wie wirkt osmotischer Druck im Kreislaufsystem?
Der osmotische Druck steuert den Wasserhaushalt zwischen Blutplasma und Gewebe.
In den Kapillaren sorgt er dafür, dass rund 90 % des filtrierten Volumens wieder zurück in die Blutbahn gelangen.
- Filtrationsdruck und osmotischer Druck stehen in ständigem Gleichgewicht
- Nettofiltrat pro Tag: etwa 20 l
Ohne diesen feinen Abgleich würden wir permanent Flüssigkeit verlieren oder anschwemmen.
Laborverfahren zur Messung von Diffusion und Osmose
Für die präzise Untersuchung setzen Mediziner verschiedene Techniken ein:
- Dialysemembran-Test: Bestimmt die Permeabilität für spezifische Moleküle
- Osmometer: Misst den osmotischen Druck in Blut- oder Gewebeproben
- FRAP (Fluorescence Recovery after Photobleaching): Ermittelt Diffusionskoeffizienten in Zellkulturen
| Verfahren | Messgröße | Typische Anwendung |
|---|---|---|
| Dialysemembran-Test | Permeabilität | Membranforschung |
| Osmometer | Osmotischer Druck (mOsmol) | Klinische Analytik |
| FRAP | Diffusionskoeffizient (D) | Zellbiologische Experimente |
„Der osmotische Druck ist ausschlaggebend für den Flüssigkeitsaustausch zwischen intravasalem und interstitiellem Raum“, so ein Laborleiter.
Wo liegen häufige Messfehler?
Messungen zu Diffusion und Osmose können durch einfache Faktoren verzerrt werden.
Bis zu 15 % Abweichung sind keine Seltenheit, wenn Geräte nicht optimal kalibriert sind.
- Ungenaue Temperaturkontrolle verschiebt Konzentrationsgradienten
- Unzureichende Probenreinigung führt zu verfälschten Ergebnissen
- Luftblasen stören photometrische und volumetrische Verfahren
Tipp: Spüle und kalibriere alle Geräte vor jedem Versuch gründlich.
Weitere Links und Tools
Zur Vertiefung empfehlen sich folgende Ressourcen:
- ChemAxon – interaktive Webapps für chemische Berechnungen
- MATLAB – Skripte zur Modellierung von Flussraten
- FRAPanalyse – Open-Source-Software für FRAP-Daten
- Wikipedia – Osmose – Überblick zu Verfahren und Begriffen
- BioMedTutorials auf YouTube – praxisnahe Videoanleitungen
Welche weiterführenden Prüfungsfragen lohnen sich?
Nutze Aufgaben, die Theorie und Praxis kombinieren:
- Berechne J bei D = 1·10⁻⁹ m²/s, ΔC = 2 mol/m³ und dx = 1 µm.
- Ermittele π für c = 0,15 mol/L, i = 2 und T = 310 K.
Für die Prüfung: Simuliere reale Messbedingungen und dokumentiere Einheiten stets korrekt.
Wie unterscheiden sich die mathematischen Beschreibungen?
Beide Prozesse lassen sich klar mit Formeln erfassen:
- Fick’sches Gesetz: J = –D·dC/dx beschreibt den Teilchenfluss proportional zum Gradient
- van’t Hoff Gesetz: π = i·c·R·T definiert den osmotischen Druck in Lösungen
In der Zellbiologie kombiniert man oft beide Ansätze, um Transportraten und Wasserbewegung simultan zu modellieren.
Praktische Demo-Videos
Anschauliche Experimente gibt es auf YouTube:
- Dialysemembran-Tests im Zeitraffer
- FRAP-Versuche mit Zellkulturen
Empfehlung: Kanal BioMedTutorials für detaillierte Labormethoden.
Entdecke hochwertige Anatomiebilder und Lernposter bei Animus Medicus
Besuche jetzt unseren Shop: https://animus-medicus.de
Viel Erfolg dir!